
2025年10月17-21日,全球最权威和领先的肿瘤学术会议之一,欧洲肿瘤内科学会(ESMO)年会正如火如荼的召开。华赛伯曼在会议上首次面向全球公布FAST-TIL(HS-IT101) I期黑色素瘤临床试验数据,该研究取得了前所未有的良好疗效,多名患者取得持续的疾病缓解(CR/PR),数据截止时中位随访已超过5个月,中位无进展生存期(mPFS)仍未达到!除此之外,该产品多项关键性创新改变了TIL细胞治疗当前取材难、风险大和价格高的临床现状。

来源:ESMO官网

数据总览——黑色素瘤初试牛刀
FAST-TIL(HS-IT101)的I期临床试验针对标准治疗失败的晚期黑色素瘤、非小细胞肺癌和其他类型的实体肿瘤患者。本次面向全球公布的为黑色素瘤亚组的临床数据。截止2025年10月,疗效分析集共有10例晚期黑色素瘤受试者完成FAST-TIL(HS-IT101)治疗和至少一次肿瘤评估,其中4人取得确认的疾病缓解(1CR、3PR),ORR达40%(美国已上市产品AMTAGVI ORR为31.4%),DCR达100%;中位随访5个月,mPFS未达到(AMTAGVI mPFS为4.2个月)。
值得一提的是,多数患者出现了深度的疾病缓解(Deepened Response),细胞输注后病灶在随访期内持续缩小(最长已超过1年),疗效数据将在后续随访中得到进一步的刷新。所有入组的患者均未发生任何ICU入住和死亡事件,TIL治疗相关的不良反应均在短期内的恢复,显示出FAST-TIL良好的安全性。
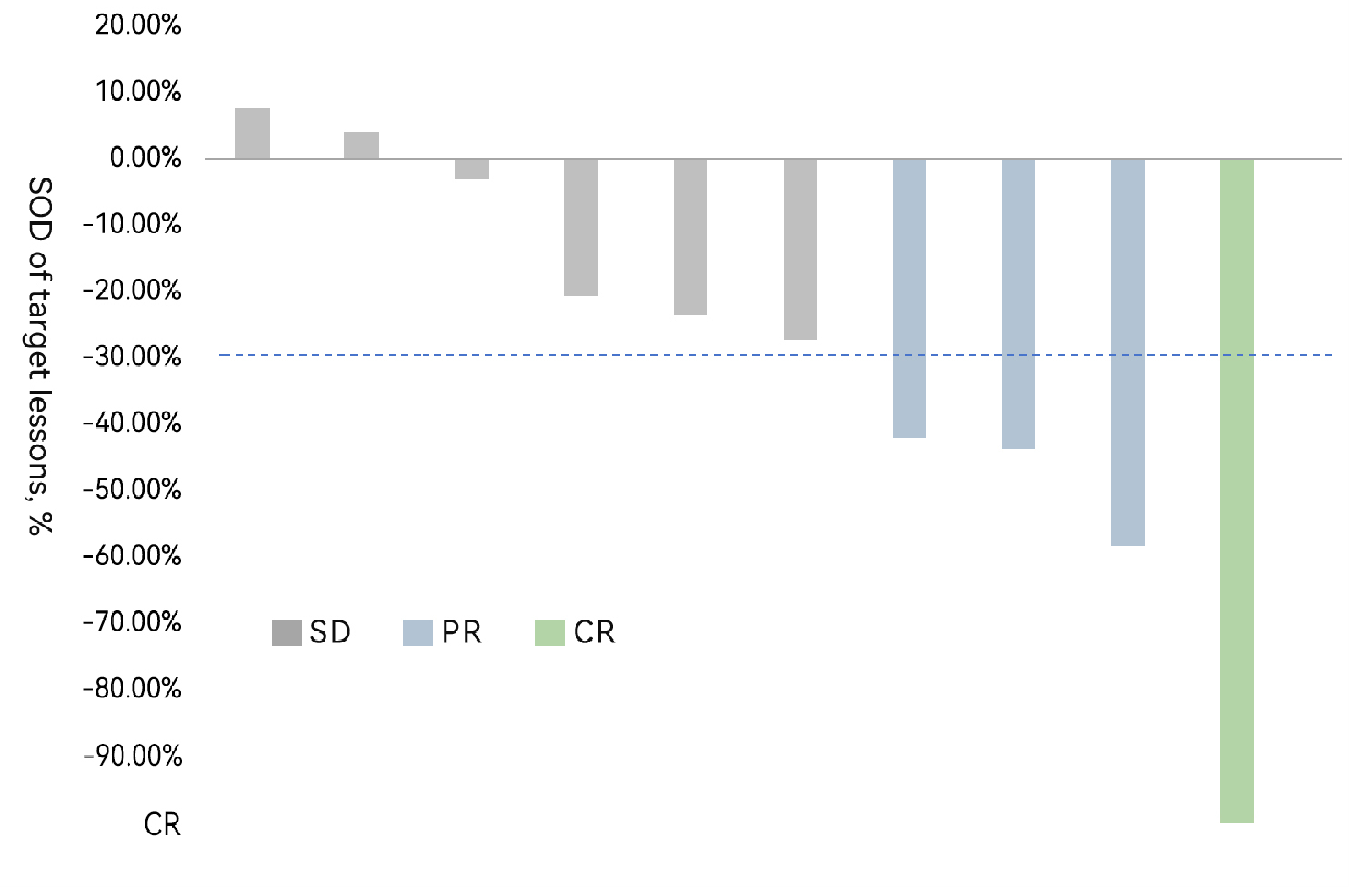
黑色素瘤受试者FAST-TIL(HS-IT101)治疗后靶病灶总和(SOD)变化
创新正名——全面击破TIL痛点
在2025 AACR和2025 ASCO两次大会中,华赛伯曼先后向大家展示了FAST-TIL从工艺生产到临床试验中的全流程创新设计。
全封闭自动化培养;
生产时间更短;
肿瘤组织需求量更少;
IL-2依赖程度更低;
高干性、低耗竭;
临床方案更安全;
综合成本大幅降低。
但临床疗效是验证产品设计的黄金标准,以上FAST-TIL(HS-IT101)针对传统TIL痛点的突破性创新,都在I期临床数据的加持之下显得更加夺目!FAST-TIL已为自己正名,成为真正意义上的更可及、更安全、更有效的新一代TIL细胞治疗产品。
剑指未来——照亮实体瘤治疗新纪元
FAST-TIL(HS-IT101)黑色素瘤治疗即将进入晚期黑色素瘤治疗关键II期临床试验阶段。同时华赛伯曼也已在非小细胞肺癌、头颈部肿瘤等中国高发肿瘤类型的TIL临床试验中加紧探索,并将继续加强与业内各方的全面合作,加速临床试验进程,争取产品早日上市惠及广大的实体肿瘤患者。
TIL以其自身难以比拟的产品特性,向我们展现了实体肿瘤治愈的新希望。TIL细胞治疗药物AMTAGVI的获批上市,已经将我们带入了实体肿瘤治疗的新纪元。华赛伯曼创新设计的FAST-TIL突破了传统TIL在工艺、临床和产业化上面临的重重难关,加之已经取得的优异疗效,无疑为这个纪元带来了更加明媚的阳光。TIL必将引领大家走向实体肿瘤治疗更好的未来。
✱ 公司特别声明,本新闻公告旨在发布研发临床进展信息及医药前沿信息,仅供医疗卫生专业人士参阅,非广告用途,本公司不对任何未经批准的药品和/或适应症作推荐。



